

服務介紹
熒光素酶報告實驗是指以熒光素為底物來檢測熒光素酶活性的一種報告基因系統,通過熒光測定儀檢測該報告基因系統中釋放的生物熒光,從而反映基因是否存在靶向互作。

技術優勢
1. 靈敏度高,比Western blot靈敏度高1000倍以上;
2. 內源性低,哺乳動物無內源性表達;
3. 熒光素酶檢測不受細胞內其他物質影響;
4. 發光檢測,檢測方便;
5. 檢測范圍廣;
6. 采用瞬時轉染技術,操作簡便、快速,周期短,適用于絕大多數細胞類型。
客戶提供
1. circRNA可提供circBase/circBank ID;mRNA/lncRNA可提供轉錄本ID(如NCBI編號NM_001126113.2);
2. 結合位點信息:預測結合位點圖片或文檔(具體序列);
3. 檢測使用的細胞;
4. 雙熒光素酶檢測的分組信息。
我們提供
1. 質粒10μg+菌液200μl;
2. 載體構建+雙熒光素酶實驗報告;
3. 剩余的模擬物。
案例1
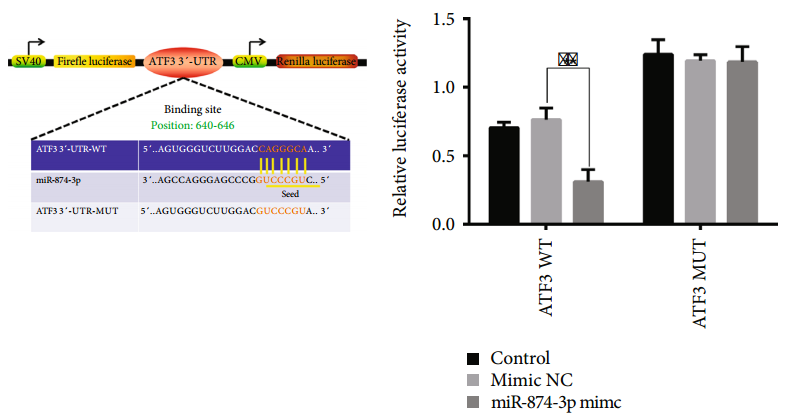
參考文獻:
Li Y, Pan D et al. Silencing ATF3 Might Delay TBHP-Induced Intervertebral Disc Degeneration by Repressing NPC Ferroptosis, Apoptosis, and ECM Degradation. Oxid Med Cell Longev. 2022 :4235126.
案例2

參考文獻:
Ma L et al. Silencing of circRACGAP1 sensitizes gastric cancer cells to apatinib via modulating autophagy by targeting miR-3657 and ATG7. Cell Death Dis. 2020 , 11(3):169.
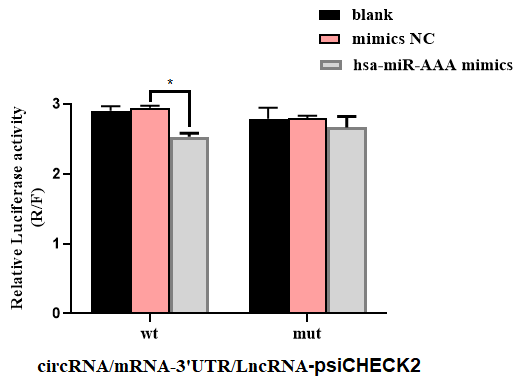
模擬物與靶基因作用情況
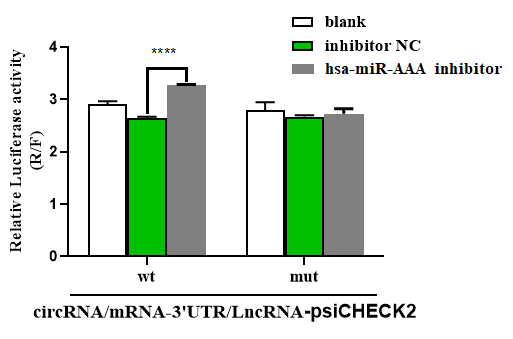
抑制劑與靶基因作用情況
1、雙熒光素酶實驗檢測數值太低是什么原因?
正常表達水平下,熒光值的數量級應在10 4次方-10 7次方數量級左右,導致數值低主要有以下幾個原因:啟動子活性、轉染效率低、裂解不充分、底物失效、操作不規范等原因,具體的原因需要實驗者進行排查。
1.1 轉染效率低
a. 優化轉染實驗條件,用較易轉染的質粒做陽性對照(如轉染過表達熒光蛋白質粒);
b. 確保轉染DNA的質量,可通過酶切或瓊脂糖凝膠電泳的方法對DNA質量進行鑒定;
c. 選擇活性較高,處于指數分裂期的細胞進行轉染。
1.2 啟動子活性低或誘導失敗
a. 轉染后的細胞培養使用特異性誘導啟動子的條件;
b. 優化細胞的培養條件,提高熒光素酶的表達量;
c. 更換強啟動子(如SV40、CMV)。
注:海腎熒光素酶基因作為內對照,其表達應不受時期、部位、環境影響,因此常用組成型表達的TK啟動子。
1.3 樣品裂解效率低
a. 細胞培養時間不宜過長,12-36h內最好,長時間培養后,細胞可能會難裂解。
b. 加入的裂解液需足量,保證細胞能夠充分裂解。
1.4 檢測過程操作不規范
a. 選擇合適的檢測儀器,能夠檢測化學發光或者生物發光的儀器都適用于該實驗;
b. 需加入足量底物,保證底物的飽和,否則會造成檢測結果出現很大偏差;
c. 室溫反應。反應時各個組分(細胞裂解產物,底物工作液等)都需要調整到室溫;
d. 熒光素酶的半衰期一般約30min,加完底物后可立即檢測,盡量在30min內完成裂解。
1.5 底物氧化失效
a. 底物避光密封保存,螢火蟲熒光素酶底物-20℃保存;海腎熒光素酶底物推薦-80℃保存;
b. 反應工作液建議現用現配。
2、雙熒光素酶熒光值過高的原因?
熒光值過高可能會超出儀器檢測范圍,從而檢測不到值,一般讀數在5-6位之間較好。熒光值過高可通過以下方式嘗試解決:
a. 減少質粒轉染量;
b. 細胞樣品裂解后,離心取上清后檢測或對裂解產物進行稀釋后檢測。
注:不建議通過減少底物量來降低熒光值,需要保證底物的飽和來反映熒光素酶真實的表達水平,否則會造成檢測結果出現大的偏差。
3、雙熒光素酶復孔差異大怎么辦?
雙報告基因檢測系統較為靈敏,檢測結果受多種因素的影響,因此,一般設置3個或3個以上的復孔,復孔之間有差異是正常的,差異在同一個數量級可以接受。想要得到更準確的實驗結果,需盡量減少復孔的差異性,建議如下:
1、裂解后建議離心取上清,保證樣本均一性;
2、保證加樣的準確性;
3、樣品和底物混合后到檢測前的時間以及檢測時間應控制在相同的時間內。