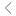- GENESEED

- 首頁
- >
- GENESEED
- >
如何從Polysome profiling入手,“拿捏”翻譯研究?(含PLUS版攻略)
應激條件下,生物體如何快速調控基因表達?
病理情況下,致病蛋白如何過量表達?
脅迫環境下,全局基因表達如何重構生存策略?
如何驗證預測潛在翻譯RNA的翻譯活性?
轉錄組和蛋白組變化水平為何不一致?
以上問題均可從RNA翻譯的角度切入深究,我們之前已經介紹過各種翻譯組分析技術,錯過的朋友可以回頭看看↓↓
推薦閱讀:收藏!翻譯組研究技術全覽:Polysome/Ribo/RNC/Disome-seq
其中Polysome profiling被廣泛應用于翻譯研究。歷久彌新的Polysome profiling還被稱為翻譯研究傳統的“金標準”。[1]
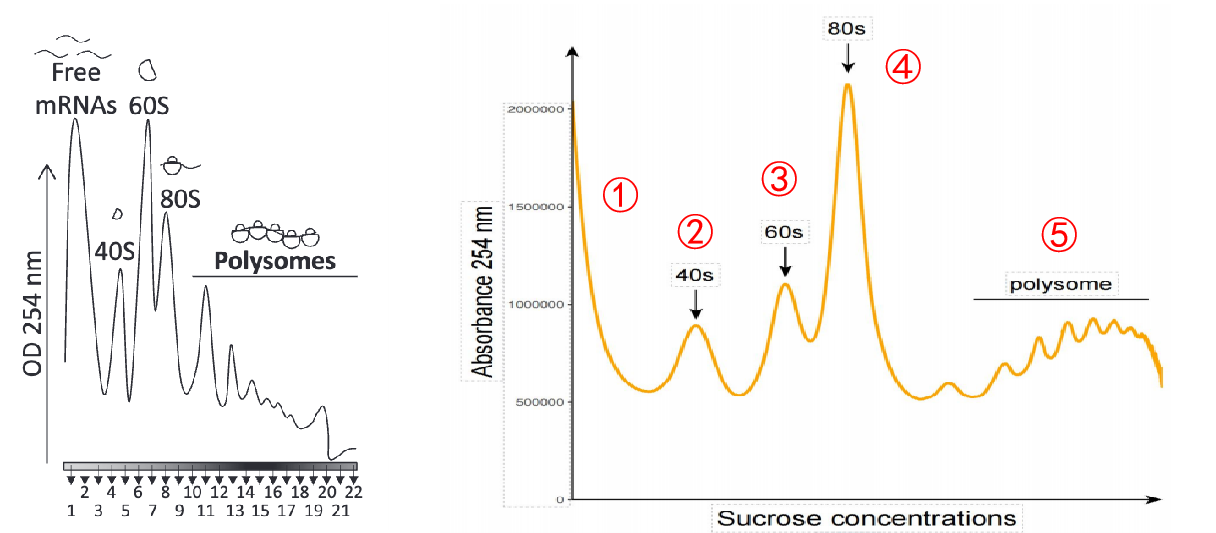
Polysome profiling原理
翻譯過程中,核糖體小亞基(40s)首先與mRNA的5’端結合,并沿5’→3’方向掃描mRNA,直到識別起始密碼子。隨后,60s核糖體大亞基在這個位置與40s亞基結合,形成具有催化活性的80s核糖體,進而啟動肽鏈延伸及蛋白合成。由于多個核糖體可以同時結合同一條mRNA,因此mRNA上結合的核糖體數量可間接反映翻譯活性。相比之下,僅結合單核糖體的RNA通常翻譯水平較低或處于翻譯停滯狀態,而僅結合核糖體亞基的RNA可能尚未啟動翻譯。
Polysome profiling技術建立于20世紀60年代,根據核糖體結合RNA的翻譯特性,結合越多核糖體的RNA沉降系數越大,基于蔗糖梯度超離心,可將細胞質RNA分離成無結合核糖體RNA(游離RNA)、結合40s和60s核糖體亞基、單核糖體(80s)和不同數量多聚核糖體等多個組分。通過分析RNA或蛋白質在不同組分的分布情況,可評估翻譯狀態,研究翻譯調控機制。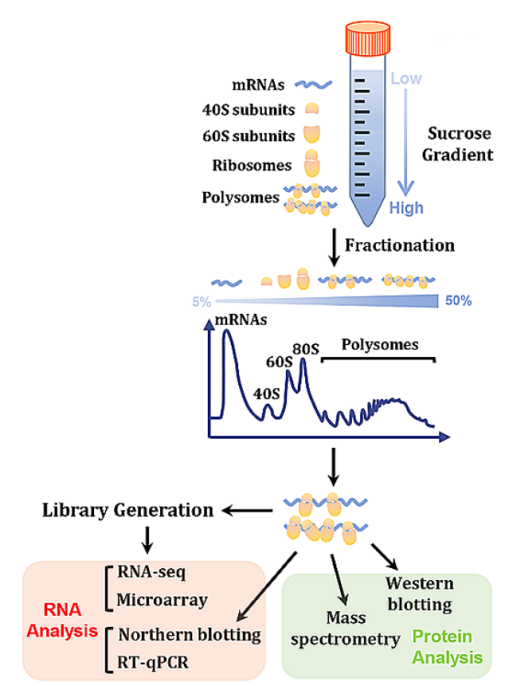
Polysome profiling技術路線圖。[1]
Polysome profiling步驟
①裂解細胞:添加翻譯延伸抑制劑,在增殖階段裂解細胞,分離細胞質裂解液;
②超速離心:把裂解液轉移到梯度蔗糖溶液后,超速離心將RNA分離成不同的組分;
③收集組分:利用密度梯度分餾系統,UV吸光度檢測核酸濃度并收集各個組分;
④回收產物:從蔗糖溶液組分中回收RNA復合物;
⑤分析產物:繪制核糖體圖譜;RT-qPCR分析特定RNA;高通量測序分析全局RNA概況;Western Blot或質譜分析蛋白質。
Polysome profiling技術優勢
①高分辨率
Polysome profiling通過分離結合不同數量核糖體的RNA,可區分不同翻譯活性的RNA,準確計算RNA的翻譯效率(TE)。
通過Polysome profiling計算TE。[2]
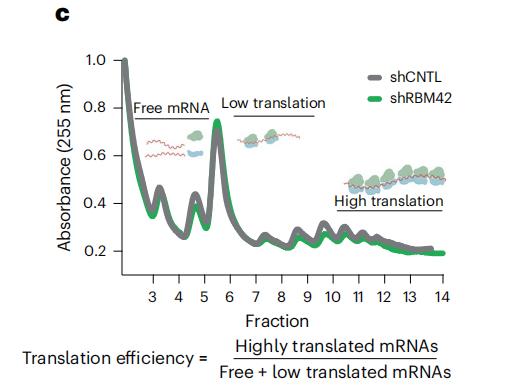
此外,Polysome profiling可作為Disome-seq等技術的預檢測環節,查看圖譜特定的峰,判斷樣本質量及是否適合下游檢測。
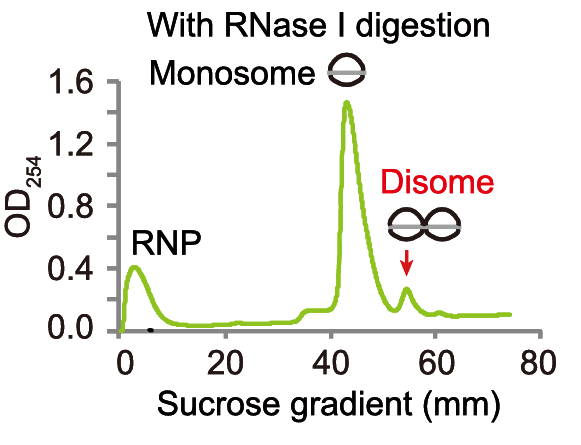
Polysome profiling中呈現雙核糖體峰。[3]
② 動態監測
Polysome profiling體現RNA在各組分的分布變化,可捕捉藥物處理、應激、病理等條件下的翻譯活性的動態變化。
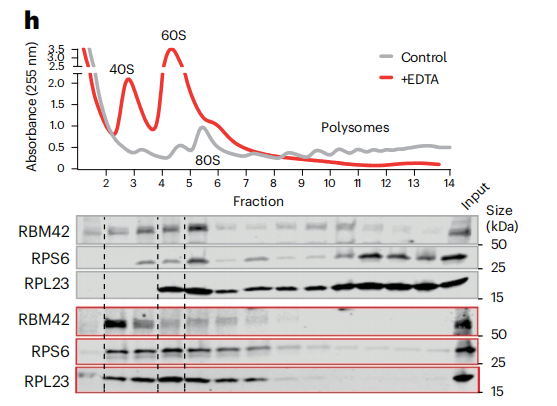
Polysome profiling分析EDTA處理和未處理的RNA翻譯狀態,同時研究翻譯調控蛋白的分布。[4]
③ 高兼容性
Polysome profiling下游產物可進行多種檢測:高通量測序分析全局翻譯狀態;RT-qPCR驗證不同條件下特定基因的翻譯狀態;WB/質譜同步驗證翻譯活性,還可分析翻譯調控因子。
④ 高靈活性
Polysome-seq可挖掘潛在翻譯的ncRNA,并結合Polysome-qPCR驗證翻譯活性。從數據庫或軟件中預測到的潛在翻譯ncRNA,也可以利用Polysome profiling+qPCR驗證可翻譯性,干濕實驗結合,性價比更高!
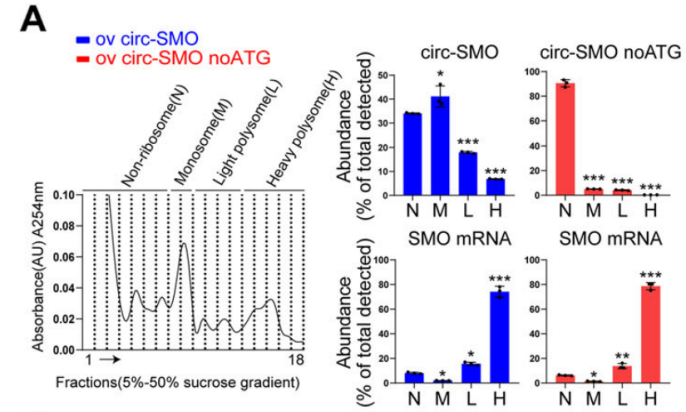
Polysome profiling驗證膠質細胞瘤中circ-SMO的可翻譯性。[5]
?
Polysome profiling難嗎?不就是蔗糖溶液密度梯度離心嗎?
對,但不全對!
① 需要專業設備:Polysome profiling需要用大型超速離心機,離心數小時以保證多個組分的清晰分離;隨后的組分檢測和收集也需專用的密度梯度分餾系統,包括流量控制的泵以及UV檢測器。
② 操作較繁瑣:需一系列繁瑣的溶液配置、離心、分離、檢測等操作步驟,耗時長且對操作者要求較高。
③ 容易受干擾:細胞內普遍存在高分子量的復合物,容易對多聚核糖體收集和檢測造成干擾。
如何利用Polysome profiling出好結果?
①準備足夠的樣本
每個樣本細胞量需≥ 1×107,且確保不同組別的樣本細胞量一致。
②做好樣本前處理
支原體檢測:收集細胞樣本(特別是用于測序的樣本)做支原體檢測,確保無支原體感染;
固定翻譯狀態:收集細胞前,細胞培養基中加入放線菌酮(cycloheximide),細菌樣本需加入氯霉素(chloramphenicol)抑制翻譯延伸;
收集細胞:對于貼壁細胞建議用胰酶消化,盡量避免用刮刀刮下細胞,而胰酶中也需加入放線菌酮。
私信公眾號后臺,發送“polysome”,可獲取詳細的Polysome profiling樣本前處理詳細步驟 。
③專業檢測
一般實驗室較少配備大型超速離心機,因此送專業的機構檢測既可解決設備問題,又可解決繁瑣且高難度的操作問題。
④合理選擇組分
產物測序分析:用于評估全局翻譯活性、篩選受翻譯調控基因、篩選可翻譯基因等。測序所需樣本較多,成本較高。因此可以適當合并組分,一般選擇一對組分用于對比,如結合多聚核糖體組分(P)vs 無結合多聚核糖體組分(NP)、結合多聚核糖體組分(P)vs無結合核糖體組分(ribosome-free)或結合多聚核糖體組分(P)vs總RNA等。
產物qPCR/WB檢測:用于驗證階段,為準確評估RNA在各組分的分布變化,應盡量細分組分,獲取足夠的數據點,更準確地呈現特定RNA的翻譯活性變化。

吉賽Polysome profiling plus

助力攻克各種翻譯研究難題
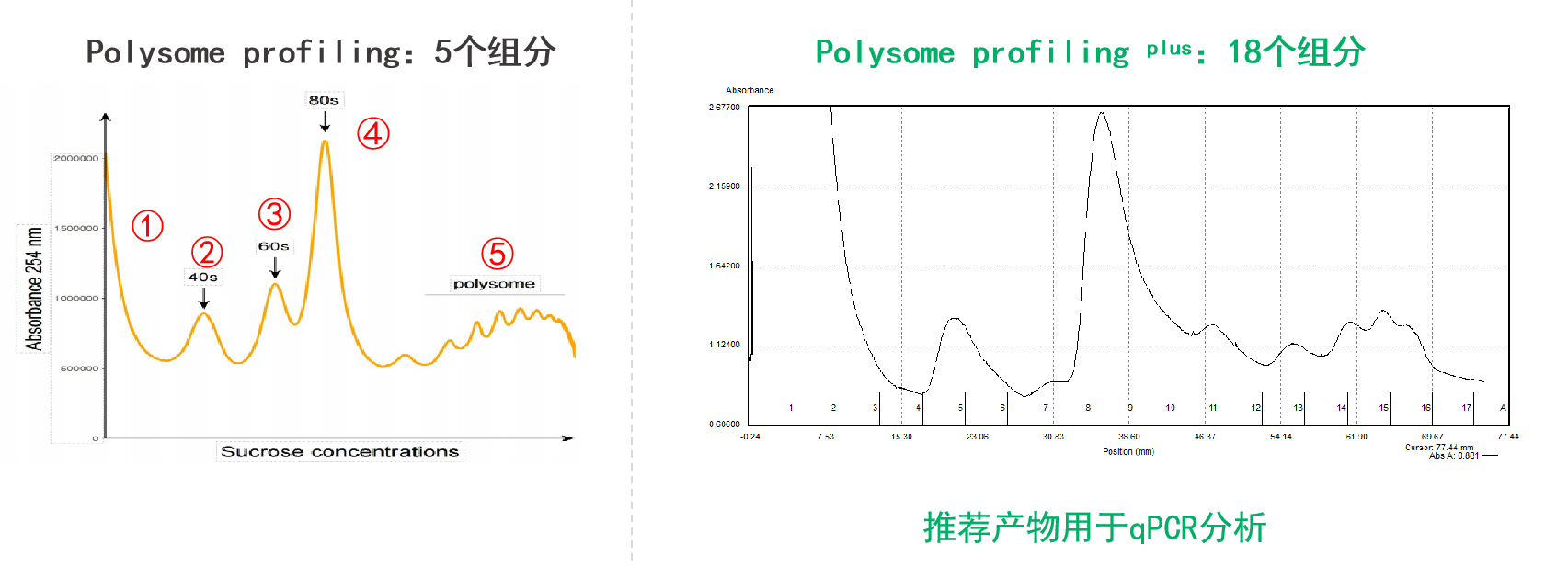
Polysome profiling plus升級內容:
①根據沉降系數大小,提供沉降系數從小到大共18個分離的組分,可增加RT-qPCR數據點,繪制更詳細的翻譯動態折線圖,更精準反映翻譯活性的動態變化;
②增加RNA質控,檢測RNA完整性,確保下游的分析:
如送樣不均衡,可根據質檢結果進行相對等量上機(但不一定準,因為復合物含核酸和核糖體、蛋白等)
③能處理的樣本類型增多:包括細胞、組織、細菌、真菌菌體等。
④統計AUC值(P/non-P ratio常用于表征樣品整體的翻譯活性)
例:
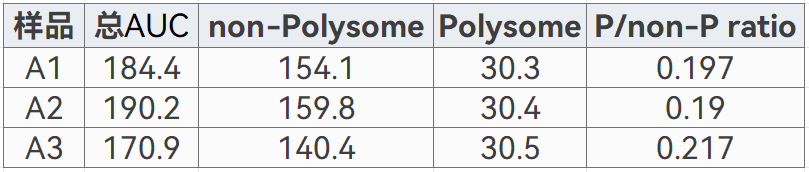
Polysome profiling 擴展包

參考資料
[1] Su D, et al. Ribosome profiling: a powerful tool in oncological research. Biomark Res. 2024, 12(1):11.
[2] Kovalski JR, et al. Functional screen identifies RBM42 as a mediator of oncogenic mRNA translation specificity. Nat Cell Biol. 2025 Mar;27(3):518-529.
[3] Zhao T, et al. Disome-seq reveals widespread ribosome collisions that promote cotranslational protein folding. Genome Biol. 2021 Jan 5;22(1):16.
[4] Kovalski JR, et al. Functional screen identifies RBM42 as a mediator of oncogenic mRNA translation specificity. Nat Cell Biol. 2025 Mar;27(3):518-529.
[5] Wu X, et al. A novel protein encoded by circular SMO RNA is essential for Hedgehog signaling activation and glioblastoma tumorigenicity. Genome Biol. 2021;22(1):33.